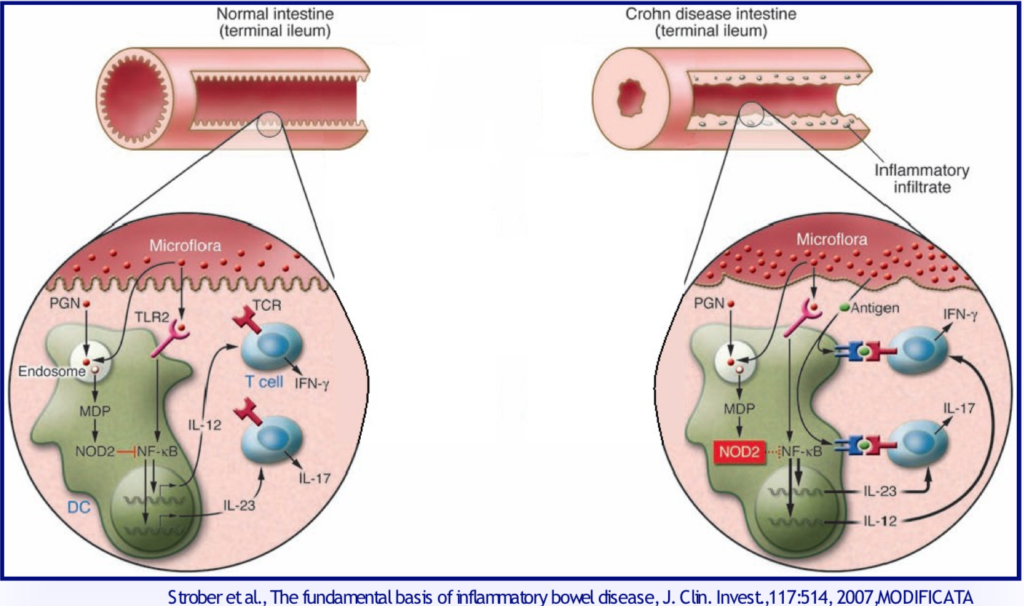
Un importante fattore patogenetico delle MICI è una disfunzione del sistema immunitario della mucosa intestinale. La risposta immunitaria è scatenata da fattori ambientali e da alcuni batteri enterici in soggetti geneticamente suscettibili ed è inappropriata. La disfunzione immunitaria induce infiammazione intestinale tramite l’attivazione dei fattori immunitari innati e acquisiti. Centrale nei meccanismi cellulari coinvolti nell’infiammazione cronica è l’interfaccia tessuto-environment, dove deve essere mantenuto un preciso equilibrio tra processi di difesa e quelli di attivazione infiammatoria incontrollata e continuativa. In questo campo importante è il ruolo dello stress del del reticolo endoplasmico (RE) e dell’autofagia. Il reticolo endoplasmico reagisce con una specifica risposta alla presenza di proteine anomale al suo interno nel tentativo di riequilibrio. Se si verifica un’alterazione genetica o epigenetica del RE, evidenziate nei pazienti con Crohn, le cellule di Paneth e le goblet cells secretorie della mucosa intestinale, non rispondono adeguatamente agli stimoli ambientali. I fattori ambientali possono agire direttamente sulla mucosa intestinale alterandone la permeabilità e la funzione immunitaria e determinando un’infiammazione cronica intestinale.
I Toll-like receptors (TLRs) rappresentano un’interfaccia tra la barriera epiteliale intestinale, il microbiota e il sistema immunitario; sono espressi da varie cellule del sistema immunitario come macrofagi, cellule dendritiche e T linfociti. Riconoscono i patogeni e identificano il pattern molecolare del microbo (MAMP). Nell’uomo sono espressi 10 TLRs, ognuno dei quali risponde a un distinto MAMP. Nelle MICI sono stati identificati polimorfismi di vari geni (TLR1, TLR2, TLR6), associati a differenti quadri clinici delle malattie.
La componente dietetica può agire sia per diretta esposizione agli antigeni dietetici, o con alterazione del microbioma o alterando la permeabilità intestinale. Per quanto concerne gli stimoli ambientali alimentari sono noti alcuni aspetti:
- gli zuccheri semplici sembrano essere un fattore di rischio di malattia, pur se con dati non univoci. Il consumo di glicidi e zuccheri semplici determina una variazione della concentrazione di glucosio cellulare, che puòalterare i pattern di glicosilazione e la quantità di proteine glicosilate (costituenti maggiori dello strato di mucina che ricopre le cellule epiteliali dell’ileo e del colon), determinando un aumento di degradazione dei batteri mucolitici, e una loro maggiore sopravvivenza a contatto con l’epitelio.
- un alto consumo di lipidi animali, sembra essere associato a incremento di rischio di MICI. L’azione dei lipidi saturi e insaturi potrebbe realizzarsi tramite una modulazione dei Toll-like receptors nei macrofagi. Qualche evidenza collega l’ingestione di lipidi con la disbiosi
- un elevato consumo di proteine è correlato con un’incremento significativo delle MICI. Il possibile meccanismo d’azione potrebbe essere rappresentato da allergia alle proteine del latte di mucca e da infezione da Mycobacterium avium paratuberculosis, presente nell’ambiente (acque e cibi), con eventuale fortificazione della sua invasività indotta da latte, carne e zucchero
- alcune evidenze collegano le MICI con l’utilizzazione industriale di additivi. Le maltodestrine sono state collegate alla sensibilizzazione intestinale ed al danno batterico tramite l’alterazione della risposta cellulare anti-batterica, la riduzione della barriera difensiva della mucosa e la promozione dell’adesività di ceppi E. coli. Gli emulsificanti (carbossimetilcellulosa, carrageenan, xanthan, Maltodestrine) sono collegati alla riduzione della viscosità e facilitano la traslocazione batterica
- le microparticelle (diossido di titanio, silicati di alluminio,talco, utilizzati negli anti-acidi e nei cibi in polvere per prevenire la formazione di grumi) sono assorbite da cellule M specializzate, ma sono indegradabili e si accumulano nei macrofagi e nel tessuto linfoide, inducendo la secrezione di interleuchine proinfiammatorie IL-1β e IL-18.
Gli alimenti possono anche agire in senso “protettivo” riducendo il rilascio di citochine pro-infiammatorie dai T linfociti intestinali: quest’azione è stata dimostrata da parte di polifenoli derivati dalle cipolle, curcuma, uva rossa, tè verde, açai berries. Vari polifenoli vegetali possono inibire l’attivazione polifenoli vegetali infiammatoria determinata dal complesso TNFα: in un recente studio ciò è stato dimostrato per vari polifenoli tra cui: curcumin, resveratrol, genistein, epigallocatechin, gallate, flavopiridol
Sintomi
I sintomi della Malattia di Crohn variano in funzione della localizzazione e della severità dell’infiammazione. In genere, si possono suddividere in due grandi categorie:
SINTOMI GASTROINTESTINALI
- nausea, vomito
- diarrea cronica e occasionale con possibile presenza di sangue nelle feci (l’infiammazione causa una grande perdita di liquidi dalle mucose intestinali che, non potendo essere riassorbiti causano diarrea costringendo la persona alla continua e urgente ricerca di una toilette)
- dolori/crampi addominali (il dolore è causato sia dall’infiammazione in sé che dal conseguente rigonfiamento delle pareti intestinali)
- meteorismo/flatulenza (sviluppo di gas a livello addominale)
- afte e fistole (a seconda delle sedi interessate, l’infiammazione cronica può causare ulcerazione delle pareti del tratto gastrointestinale con la formazione di afte a livello del cavo orale, ulcerazioni a livello intestinale. Quando l’ulcerazione interessa l’ultimo tratto dell’intestino, e’ possibile la formazione di fistole dolorose nella zona anale).
SINTOMI EXTRAINTESTINALI
- stanchezza e affaticamento generalizzato associati a febbre persistente (sintomi scaturiti dal processo infiammatorio e/o da eventuali ascessi/complicazioni infettive)
- riduzione dell’appetito e perdita di peso (il dolore e le possibili difficoltà a digerire e assimilare il cibo possono infatti determinare un dimagrimento)
- ritardo nella crescita (nei bambini con MdC può verificarsi un ritardo nell’accrescimento e/o nello sviluppo sessuale a causa della malnutrizione e/o malassorbimento indotti dalla patologia)
- sintomi a carico dell’apparato circolatorio (aritmie, ipotensione, anemia)
- sintomi a carico dell’apparato respiratorio (tosse, naso gocciolante, difficoltà respiratoria)
- sintomi a carico dell’apparato neurologico (capogiri, vertigini, cefalee, svenimenti)
- sintomi a carico del cavo orofaringeo (gonfiore delle labbra, secchezza della bocca, voce rauca)
Proprio il carattere non specifico dei sintomi, facilmente riconducibili a condizioni cliniche diverse, può causare un ritardo nella diagnosi della Malattia di Crohn.
Complicanze
La Malattia di Crohn, se non adeguatamente trattata, può presentare una serie di complicanze, tra cui le principali sono:
- occlusione intestinale: è la complicanza più frequente in cui l’infiammazione cronica a carico delle mucose causa restringimenti del cavo intestinale (stenosi) con ostruzione parziale o totale del transito intestinale. In questi casi, si interviene con terapia medica ma, più frequentemente, con trattamento chirurgico.
- ascesso perianale: le fistole perianali possono infettarsi e causare dolore e febbre rendendo necessaria una terapia antibiotica e spesso anche chirurgica.
- perforazione intestinale: in fasi particolarmente acute e gravi della malattia, il processo infiammatorio produce ulcerazioni che, se di dimensioni importanti, possono portare alla perforazione della parete dell’intestino.
Altre complicanze extraintestinali sono: artrite, spondilite/sacroilite, malattie del fegato e delle vie biliari, infiammazioni a carico di altri organi e tessuti (occhi e pelle).
Diagnosi e prevenzione
Il corteo sintomatologico del Crohn deve essere attentamente valutato per poter porre una diagnosi differenziale rispetto ad altre patologie addominali. La diagnosi di certezza si ottiene tramite la combinazione dei segni e sintomi clinici associati a test di laboratorio, esami radiologici, endoscopici e bioptici. L’accertamento di prima linea nel sospetto diagnostico di morbo di Crohn è attualmente la colonscopia con prelievi bioptici. L’accertamento istologico tramite multipli prelievi bioptici eseguiti su retto, colon e segmento terminale del tenue consente la diagnosi di maggior affidabilità. Esami di secondo livello, sono la TAC e la risonanza magnetica e più precisamente l’enteroTAC e la l’entreroRMN, che consentono di valutare l’estensione e l’attività flogistica della malattia valutando lo spessore della mucosa, la presenza di edema, e di ulcerazioni.
Purtroppo non si può prevenire l’insorgenza della malattia di Crohn, ma si possono prevenirne le complicanze e l’evoluzione e per questo occorrono:
- una diagnosi precoce di malattia: che consiste nel richiedere esami del sangue, delle feci e un esame non invasivo dell’addome (ecografia o TC o RMN) in caso di diarrea e/o dolori addominali continui per più di 4 settimane, perdita di peso, sintomi notturni, specie in soggetti con familiarità per malattie autoimmuni.
- la prevenzione delle complicanze, eseguendo esami del sangue e delle feci ogni 6-12 mesi, e un esame non invasivo dell’addome (ecografia TC o RMN) almeno ogni anno, integrato, se necessario da una colonscopia
- la prevenzione delle neoplasie intestinali eseguendo una colonscopia con biopsie seriate ogni 12 mesi in caso di morbo di Crohn estesa nel colon, a partire dai 10 anni dalla diagnosi
- la prevenzione delle infezioni opportunistiche, nei pazienti che si sottopongono a terapie immunosoppressive croniche per la morbo di Crohn, eseguendo vaccinazione anti-influenzale ogni 12 mesi, vaccinazione anti-pneumococco ogni 5 anni, e vaccinazione per l’epatite B al momento della diagnosi, se non già effettuata. Nelle donne, è consigliato, in questi casi, anche la vaccinazione per l’HPV.
Terapia
La terapia per la malattia di Crohn ha lo scopo di attenuare l’infiammazione intestinale, attraverso l’azione sui meccanismi cellulari e molecolari dell’intestino e del sistema immunitario. Le MICI (malattie infiammatorie croniche intestinali) se non opportunamente trattate possono portare a malnutrizione per malassorbimento, maldigestione, aumento dei fabbisogni dovuti ad infezioni e riduzione dell’introito alimentare. E’ importante, nel trattamento del morbo di Crohn, oltre alla terapia farmacologica, la correzione di eventuali deficit nutrizionali e l’astensione da alcolici e fumo. I principali farmaci attualmente utilizzati nel trattamento della malattia sono:
- la mesalazina (5-ASA): agisce direttamente come anti-infiammatorio sulla mucosa intestinale durante il transito intestinale
- gli antibiotici intestinali (fluorochinolonici, metronidazolo, rifaximina): aiutano ad equilibrare la flora batterica, possibile corresponsabile dell’infiammazione, oppure a ridurre o eliminare gli ascessi
- l’azatioprina o la 6-mercaptopurina (immunosoppressori): inducono la morte della gran parte dei globuli bianchi attivati, responsabili dell’infiammazione
- gli steroidi: hanno una potente azione anti-infiammatoria a livello di tutto l’organismo, sopprimendo la risposta immunitaria e modulandola
- Il metotrexate: agisce, con meccanismi diversi, come immunosoppressore che distrugge buona parte dei globuli bianchi attivati
- I farmaci biologici (infliximab, adalimumab): anticorpi biotecnologici che bloccano selettivamente una delle molecole principali responsabili dell’infiammazione
- Farmaci sperimentali: possono avere vari meccanismi d’azione. Vengono utilizzati solo in Centri selezionati dove vengono somministrati nell’ambito di studi clinici.
La terapia chirurgica serve a rimuovere le complicanze irreversibili del morbo di Crohn, quando i farmaci non hanno spazio terapeutico.
Conclusioni
Secondo i dati di un’indagine realizzata dall’Effca (European Federation of Crohn’s and Ulcerative Colitis Associations) il 24% dei malati di Crohn ha dichiarato di essere stato palesemente discriminato sul luogo di lavoro. Il 51% ha ammesso che le proprie prospettive lavorative sono state influenzate negativamente dalla malattia. Ma i più colpiti da discriminazioni in ambito lavorativo sono le persone che per essere affette da malattia infiammatoria si trovano disoccupate o sottoccupate. Le stime prodotte da un’altra ricerca che l’associazione Amici ha condotto in collaborazione con l’Alta Scuola di economia e management dei sistemi sanitari dell’università Cattolica di Roma chiariscono che il costo medio annuo a carico dei malati di Malattie Infiammatorie Intestinali è di circa 746 euro, ma se si tiene conto della perdita di produttività generate dalla malattia o dall’avere un familiare affetto dalla malattia la cifra sale a 2.258 euro. L’impatto economico e sociale delle MICI risulta oneroso, non solo per i pazienti, ma anche per il sistema sanitario nazionale e per l’intera società. Spesso il paziente affetto da MICI riceve la diagnosi a qualche anno di distanza dai primi sintomi, con peggioramento della qualità di vita a volte anche permanente, per questo è importante l’attività scientifica, educazionale e istituzionale. Quello per Il morbo di Crohn è un trend di spesa destinato probabilmente a crescere se non sarà affrontato con un approccio olistico che vede impegnati Istituzioni, clinici e rappresentanti dei pazienti nella valutazione di tutti gli indicatori sociali ed economici a disposizione.
Bibliografia
- Alois Hollerweger, Klaus Dirks, Kazimierz Szopinski: “Transabdominal ultrasound of the gastrointestinal tract” EFSUMB – European Course Book- 2011;
- Amy K. Hara, Shayan Alam, Russell I. Heigh, Suryakanth R.Gurudu, Joseph G. Hentz, Jonathan A. Leighton “ Using CT Enterography to monitor Crohn’s Disease Activity: a preliminary study”; AJR 2008; 190:1512–1516;
- Burisch J, Pedersen N, Cukovi X0107-Cavka S, et al.; for the EpiCom-group. East-West gradient in the incidence of inflammatory bowel disease in Europe: the ECCO-EpiCom inception cohort. Gut 2014; 63: 588-597
- Drews BH, Barth TF, Haenle MM et al.: “Comparison of sonographically measured bowel wall vascularity, histology, and disease activity in Crohn’s disease” Eur. Radiol. 2009 Jun; 19(6):1379-1386 ;.
- E. Colombo, F. Bossa, V. Annese “Inquadramento diagnostico delle malattie infiammatorie croniche intestinali” in Terapia delle Malattie Infiammatorie Croniche Intestinali, Immagine Ed.2009;
- Fraquelli, Colli A, Casazza G, Paggi S, Colucci A, Massironi S, Duca P, Conte D. Role of US in detection of Crohn disease: meta-analysis. Radiology 2005; 236: 95-101
- Kim AY, Yang SK, Chung JW, Kim SY, Park SH, Ha HK. Crohn disease of the small bowel: comparison of CT enterography, MR enterography, and small-bowel follow-through as diagnostic techniques. Radiology 2009; 251: 751-761
- Lee SS, Kim AY, Yang SK, Chung JW, Kim SY, Park SH, Ha HK. Crohn disease of the small bowel: comparison of CT enterography, MR enterography, and small-bowel follow-through as diagnostic techniques. Radiology 2009; 251: 751-761
- Louis E, Collard A, Oger AF, Degroote E, Aboul Nasar El Yagi FA, Belaiche J. Behaviour of Crohn’s disease according to the Vienna classification: changing pattern over the course of the disease. Gut 2001;49(6):777–82.
- Martinez MJ, Ripollés T, Paredes JM, Blanc E, Marti-Bonmati L. Assessment of the extension and the inflammatory activity in Crohn’s disease: comparison of ultrasound and MRI. Abdom Imaging 2009;34(2):141–8.
- Ng SC, Tang W, Ching JY, Wong M, et al. Incidence and phenotype of inflammatory bowel disease based on results from the Asia-pacific Crohn’ s and colitis epidemiology study. Gastroenterology 2013; 145:158-165.e2Lee SS,
- Natalie A, Malodecky et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology 2012;142:46-54
- Parfenov Al. Crohn’s disease: on the occasion of the 80th anniversary of description. Ter Arkh 2013; 85:35-42.
- Sands BE. From symptom to diagnosis: clinical distinctions among various forms of intestinal inflammation Gastroenterology 2004;126(6):1518–32.
- Silverberg MS, Satsangi J, Ahmad T, Arnott ID, Bernstein CN, Brant SR, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: Report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005;19(Suppl A): 5–36.
- S. Giusti, L. Faggioni, E. Neri, E. Fruzzetti, L. Nardini, S. Marchi, C. Bartolozzi: “Dynamic MRI of the small bowel: usefulness of quantitative contrast-enhancement parameters and time–signal intensity curves for differentiating between active and inactive Crohn’s disease”; Abdom Imaging (2010) 35:646–653;
- Vincenzo Migaleddu, Emilio Quaia, Domenico Scanu, Serra Carla, Michele Bertolotto, Girolamo Campisi, Danilo Sirigu, Giuseppe Virgilio. Inflammatory activity in Crohn’s disease: CE-US. Abdom Imaging (2011) 36:142–148.